Аўтар:
Christy White
Дата Стварэння:
8 Травень 2021
Дата Абнаўлення:
1 Ліпень 2024
Задаволены
- Крок
- Спосаб 1 з 3: Частка першая: Разуменне электронных абалонак
- Спосаб 2 з 3: Частка другая: Пошук валентных электронаў у металах, акрамя пераходных металаў
- Метад 3 з 3: Частка трэцяя: Пошук валентных электронаў у пераходных металах
- Парады
- Неабходнасці
Валентныя электроны ляжаць у знешняй абалонцы элемента. Колькасць валентных электронаў у атаме вызначае тып хімічнай сувязі, якую можа ўтварыць гэты элемент. Лепшы спосаб даведацца колькасць валентных электронаў - выкарыстоўваць перыядычную сістэму элементаў.
Крок
Спосаб 1 з 3: Частка першая: Разуменне электронных абалонак
 Перыядычная сістэма элементаў. Гэта табліца з каляровымі кодамі, дзе ў кожнай ячэйцы адлюстроўваецца элемент з атамным нумарам і ад 1 да 3 літар у якасці сімвала.
Перыядычная сістэма элементаў. Гэта табліца з каляровымі кодамі, дзе ў кожнай ячэйцы адлюстроўваецца элемент з атамным нумарам і ад 1 да 3 літар у якасці сімвала.  Знайдзіце атамны нумар элемента. Атамны нумар знаходзіцца вышэй або побач з сімвалам элемента. Напрыклад: Бор (B) мае атамны нумар 5, гэта азначае, што ён мае 5 пратонаў і 5 электронаў.
Знайдзіце атамны нумар элемента. Атамны нумар знаходзіцца вышэй або побач з сімвалам элемента. Напрыклад: Бор (B) мае атамны нумар 5, гэта азначае, што ён мае 5 пратонаў і 5 электронаў.  Намалюйце простае ўяўленне атама і размесціце электроны на арбіце вакол ядра. Гэтыя працоўныя месцы яшчэ называюць абалонкамі альбо ўзроўнямі энергіі. Максімальная колькасць электронаў, якія могуць знаходзіцца ў адной і той жа абалонцы, фіксавана, і абалонкі запаўняюцца ад унутранай да знешняй арбіты.
Намалюйце простае ўяўленне атама і размесціце электроны на арбіце вакол ядра. Гэтыя працоўныя месцы яшчэ называюць абалонкамі альбо ўзроўнямі энергіі. Максімальная колькасць электронаў, якія могуць знаходзіцца ў адной і той жа абалонцы, фіксавана, і абалонкі запаўняюцца ад унутранай да знешняй арбіты. - Да абалонкі (унутраная): максімум 2 электроны.
- L абалонка: максімум 8 электронаў.
- М абалонка: максімум 18 электронаў.
- N абалонка: максімум 32 электроны.
- Аб абалонцы: максімум 50 электронаў.
- Ракавіна (вонкавая): максімум 72 электроны.
 Знайдзіце колькасць электронаў у знешняй абалонцы. Гэта валентныя электроны.
Знайдзіце колькасць электронаў у знешняй абалонцы. Гэта валентныя электроны. - Калі валентная абалонка поўная, элемент стабільны.
- Калі валентная абалонка не поўная, то элемент рэактыўны, што азначае, што ён можа хімічна звязвацца з атамам іншага элемента. Кожны атам дзеліцца сваімі валентнымі электронамі, спрабуючы зрабіць валентную абалонку поўнай.
Спосаб 2 з 3: Частка другая: Пошук валентных электронаў у металах, акрамя пераходных металаў
 Нумаруйце кожны слупок перыядычнай табліцы ад 1 да 18. Вадарод (Н) знаходзіцца ўверсе калонкі 1, а гелій (Нэ) уверсе калонкі 18. Гэта розныя групы элементаў.
Нумаруйце кожны слупок перыядычнай табліцы ад 1 да 18. Вадарод (Н) знаходзіцца ўверсе калонкі 1, а гелій (Нэ) уверсе калонкі 18. Гэта розныя групы элементаў.  Дайце кожнаму радку лічбу ад 1 да 7. Гэта перыяды стыхій, і яны адпавядаюць колькасці абалонак альбо энергетычным узроўням атама.
Дайце кожнаму радку лічбу ад 1 да 7. Гэта перыяды стыхій, і яны адпавядаюць колькасці абалонак альбо энергетычным узроўням атама. - Вадарод (H) і гелій (He) маюць па 1 абалонцы, а Francium (Fr) - 7.
- Лантаніды і актыноіды згрупаваны і пералічаны ніжэй асноўнай табліцы. Усе лантаніды належаць да перыяду 6, групы 3, а ўсе актыноіды - да перыяду 7, групы 3.
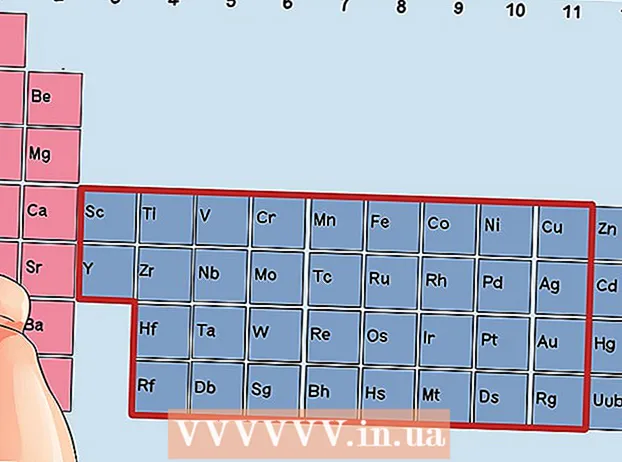
 Знайдзіце элемент, які не з'яўляецца пераходным металам. Пераходныя металы ўваходзяць у групы з 3 па 12. Нумары іншых металаў паказваюць колькасць валентных электронаў.
Знайдзіце элемент, які не з'яўляецца пераходным металам. Пераходныя металы ўваходзяць у групы з 3 па 12. Нумары іншых металаў паказваюць колькасць валентных электронаў. - Група 1: 1 валентны электрон
- Група 2: 2 валентныя электроны
- Група 13: 3 валентныя электроны
- Група 14: 4 валентныя электроны
- Група 15: 5 валентных электронаў
- Група 16: 6 валентных электронаў
- Група 17: 7 валентных электронаў
- Група 18: 8 валентных электронаў - за выключэннем гелія, які мае 2
Метад 3 з 3: Частка трэцяя: Пошук валентных электронаў у пераходных металах
 Знайдзіце элемент з груп 3 да 12 - пераходныя металы.
Знайдзіце элемент з груп 3 да 12 - пераходныя металы. Вызначце колькасць валентных электронаў, зыходзячы з ліку групы. Гэтыя нумары груп адпавядаюць магчымай колькасці валентных электронаў.
Вызначце колькасць валентных электронаў, зыходзячы з ліку групы. Гэтыя нумары груп адпавядаюць магчымай колькасці валентных электронаў. - Група 3: 3 валентныя электроны
- Група 4: ад 2 да 4 валентных электронаў
- Група 5: ад 2 да 5 валентных электронаў
- Група 6: ад 2 да 6 валентных электронаў
- Група 7: ад 2 да 7 валентных электронаў
- Група 8: 2 ці 3 валентныя электроны
- Група 9: 2 ці 3 валентныя электроны
- Група 10: 2 ці 3 валентныя электроны
- Група 11: 1 ці 2 валентныя электроны
- Група 12: 2 валентныя электроны
Парады
- Пераходныя металы могуць мець валентныя абалонкі, якія не цалкам запоўнены. Вызначэнне дакладнай колькасці валентных электронаў у пераходных металах патрабуе пэўных прынцыпаў квантавай тэорыі, якія выходзяць за рамкі дадзенай працы.
Неабходнасці
- Перыядычная табліца элементаў
- Аловак
- Папера