Аўтар:
Eugene Taylor
Дата Стварэння:
12 Жнівень 2021
Дата Абнаўлення:
22 Чэрвень 2024
Задаволены
- Крок
- Частка 1 з 2: Нармальная электронная канфігурацыя элемента
- Частка 2 з 2: Канфігурацыя высакародных газаў
- Папярэджанні
Выпісванне электроннай канфігурацыі элемента - добры спосаб паглядзець на размеркаванне электронаў у атаме. У залежнасці ад элемента, формула можа быць вельмі доўгай. Такім чынам, навукоўцы распрацавалі стэнаграфічнае абазначэнне, якое выкарыстоўвае высакародны газ для прадстаўлення электронаў, якія не з'яўляюцца валентнымі. Гэта спрашчае электронную канфігурацыю і палягчае разуменне хімічных уласцівасцей элемента.
Крок
Частка 1 з 2: Нармальная электронная канфігурацыя элемента
 Вызначце колькасць электронаў, якія прысутнічаюць у элеменце. Атамны нумар элемента кажа вам пра колькасць пратонаў, якія ён мае. Паколькі элементы ў нейтральным стане маюць аднолькавую колькасць пратонаў і электронаў, вы таксама можаце выкарыстоўваць атамны нумар як колькасць электронаў, якія мае элемент. Атамны нумар, які вы можаце знайсці ў перыядычнай табліцы, - гэта нумар прама над сімвалам элемента.
Вызначце колькасць электронаў, якія прысутнічаюць у элеменце. Атамны нумар элемента кажа вам пра колькасць пратонаў, якія ён мае. Паколькі элементы ў нейтральным стане маюць аднолькавую колькасць пратонаў і электронаў, вы таксама можаце выкарыстоўваць атамны нумар як колькасць электронаў, якія мае элемент. Атамны нумар, які вы можаце знайсці ў перыядычнай табліцы, - гэта нумар прама над сімвалам элемента. - Напрыклад, сімвал натрыю - Na. Атамны нумар Na складае 11.
 Веды пра электронныя абалонкі і ўзроўні энергіі. Першая электронная абалонка мае толькі энергетычны ўзровень s, другая электронная абалонка мае энергетычны ўзровень s і p. Трэцяя электронная абалонка мае ўзровень энергіі s, p і d. Чацвёртая электронная абалонка мае ўзровень энергіі s, p, d і f. Электронных абалонак больш за чатыры, але ў сярэдняй школе хіміі вы звычайна сустрэнеце толькі першыя чатыры.
Веды пра электронныя абалонкі і ўзроўні энергіі. Першая электронная абалонка мае толькі энергетычны ўзровень s, другая электронная абалонка мае энергетычны ўзровень s і p. Трэцяя электронная абалонка мае ўзровень энергіі s, p і d. Чацвёртая электронная абалонка мае ўзровень энергіі s, p, d і f. Электронных абалонак больш за чатыры, але ў сярэдняй школе хіміі вы звычайна сустрэнеце толькі першыя чатыры. - Кожны энергетычны ўзровень s можа ўтрымліваць да 2 электронаў.
- Кожны р энергетычнага ўзроўню можа ўтрымліваць да 6 электронаў.
- Кожны d узровень энергіі можа ўтрымліваць да 10 электронаў.
- Кожны ўзровень энергіі f можа ўтрымліваць да 14 электронаў.
 Вывучыце правілы запаўнення электронаў. Згодна з прынцыпам Аўфбау, вы павінны дадаць электроны да самых нізкіх узроўняў энергіі, перш чым электрон можна дадаць да больш высокага ўзроўню энергіі. Кожны энергетычны ўзровень можа мець некалькі субарбіталяў, але кожны субарбітал можа ўтрымліваць адначасова да двух электронаў. Энергетычны ўзровень s мае адзін субарбітал, p - 3 субарбіталі, d - 5 субарбіталяў, а f - 7 субарбіталяў.
Вывучыце правілы запаўнення электронаў. Згодна з прынцыпам Аўфбау, вы павінны дадаць электроны да самых нізкіх узроўняў энергіі, перш чым электрон можна дадаць да больш высокага ўзроўню энергіі. Кожны энергетычны ўзровень можа мець некалькі субарбіталяў, але кожны субарбітал можа ўтрымліваць адначасова да двух электронаў. Энергетычны ўзровень s мае адзін субарбітал, p - 3 субарбіталі, d - 5 субарбіталяў, а f - 7 субарбіталяў. - Узровень d энергіі мае крыху больш высокую энергію, чым ніжні ўзровень энергіі электроннай абалонкі, таму больш высокі ўзровень энергіі s хутчэй за ўсё запаўняецца, чым ніжні ўзровень d энергіі. Для напісання электроннай канфігурацыі гэта азначае, што яна будзе выглядаць так: 1s2s2p3s3p4s3d.
 Выкарыстоўвайце графік дыяганальнай канфігурацыі для запісу электронных канфігурацый. Самы просты спосаб запомніць, як запаўняюцца электроны, - выкарыстаць схему канфігурацыі. У гэтым вы запісваеце кожную абалонку і ўзроўні энергіі. Намалюйце дыяганальныя лініі зверху справа ўніз злева ад кожнай лініі. Схема канфігурацыі выглядае наступным чынам:
Выкарыстоўвайце графік дыяганальнай канфігурацыі для запісу электронных канфігурацый. Самы просты спосаб запомніць, як запаўняюцца электроны, - выкарыстаць схему канфігурацыі. У гэтым вы запісваеце кожную абалонку і ўзроўні энергіі. Намалюйце дыяганальныя лініі зверху справа ўніз злева ад кожнай лініі. Схема канфігурацыі выглядае наступным чынам: - 1с
2с 2р
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6с 6р 6д
7с 7с - Напрыклад: Электронная канфігурацыя натрыю (11 электронаў): 1s2s2p3s.
- 1с
 Вызначце апошнюю арбіталу кожнай канфігурацыі. Паглядзеўшы перыядычную сістэму, вы можаце вызначыць, якой будзе апошняя абалонка і апошні ўзровень энергіі электроннай канфігурацыі. Спачатку вызначыце, у які блок трапляе элемент (s, p, d або f). Затым падлічыце, у якім радку знаходзіцца элемент. Нарэшце, падлічыце, у якім слупку знаходзіцца элемент.
Вызначце апошнюю арбіталу кожнай канфігурацыі. Паглядзеўшы перыядычную сістэму, вы можаце вызначыць, якой будзе апошняя абалонка і апошні ўзровень энергіі электроннай канфігурацыі. Спачатку вызначыце, у які блок трапляе элемент (s, p, d або f). Затым падлічыце, у якім радку знаходзіцца элемент. Нарэшце, падлічыце, у якім слупку знаходзіцца элемент. - Напрыклад, натрый знаходзіцца ў блоку s, таму апошняя арбітала яго электроннай канфігурацыі - s. Ён знаходзіцца ў трэцім радку і ў першым слупку, таму апошняя арбітала складае 3 секунды. Гэта добры спосаб праверыць свой канчатковы адказ.
- Правіла трохі адрозніваецца для d арбіты. Першы радок элементаў d-блока пачынаецца з чацвёртага радка, але вам трэба адняць 1 ад нумара радка, таму што ўзроўні s маюць меншую энергію, чым узроўні d. Напрыклад: ванадый заканчваецца на 3d.
- Іншы спосаб праверыць сваю працу - скласці ўсе верхнія індэксы. Яны павінны быць роўныя колькасці электронаў у элеменце. Калі ў вас занадта мала ці занадта шмат электронаў, вам варта перагледзець сваю працу і паспрабаваць яшчэ раз.
Частка 2 з 2: Канфігурацыя высакародных газаў
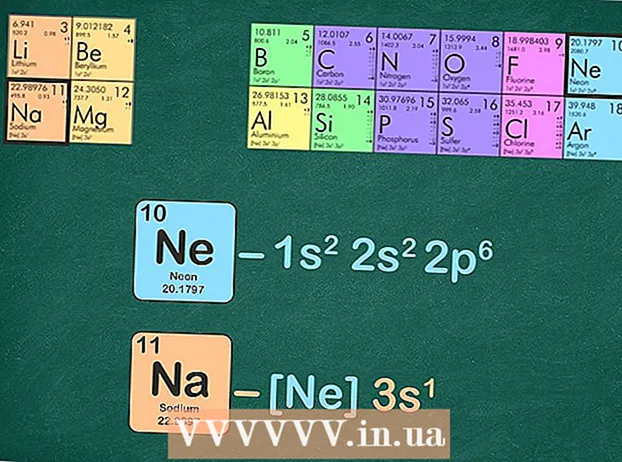
 Вызначыце электронную канфігурацыю высакароднага газу. Электронная канфігурацыя высакароднага газу - гэта своеасаблівы стэнаграфічны спосаб выпісаць поўную электронную канфігурацыю элемента. Стэнаграфія высакароднага газу выкарыстоўваецца для абагульнення электроннай канфігурацыі элемента пры прадастаўленні найбольш важнай інфармацыі пра валентныя электроны гэтага элемента.
Вызначыце электронную канфігурацыю высакароднага газу. Электронная канфігурацыя высакароднага газу - гэта своеасаблівы стэнаграфічны спосаб выпісаць поўную электронную канфігурацыю элемента. Стэнаграфія высакароднага газу выкарыстоўваецца для абагульнення электроннай канфігурацыі элемента пры прадастаўленні найбольш важнай інфармацыі пра валентныя электроны гэтага элемента. - Высакародны газ заменены, каб прадстаўляць усе электроны, якія не з'яўляюцца валентнымі.
- Высакароднымі газамі з'яўляюцца гелій, неон, аргон, крыптон, ксенон і радон і знаходзяцца ў апошняй калонцы перыядычнай табліцы.
 Вызначце высакародны газ у перыяд для вашай стыхіі. Перыяд элемента - гэта гарызантальны радок, у якім знаходзіцца элемент. Калі элемент знаходзіцца ў чацвёртым радку перыядычнай табліцы, ён знаходзіцца ў перыядзе чатыры. Высакародны газ, якім вы будзеце карыстацца, знаходзіцца ў трэцім перыядзе. Ніжэй прыведзены спіс высакародных газаў і іх перыяды:
Вызначце высакародны газ у перыяд для вашай стыхіі. Перыяд элемента - гэта гарызантальны радок, у якім знаходзіцца элемент. Калі элемент знаходзіцца ў чацвёртым радку перыядычнай табліцы, ён знаходзіцца ў перыядзе чатыры. Высакародны газ, якім вы будзеце карыстацца, знаходзіцца ў трэцім перыядзе. Ніжэй прыведзены спіс высакародных газаў і іх перыяды: - 1: гелій
- 2: Неон
- 3: Аргон
- 4: Крыптон
- 5: ксенон
- 6: Радон
- Напрыклад, натрый знаходзіцца ў перыядзе 3. Мы будзем выкарыстоўваць неон для канфігурацыі высакародных газаў, таму што ён знаходзіцца ў перыядзе 2.
 Заменіце высакародны газ той жа колькасцю электронаў, што і высакародны газ. Ёсць некалькі спосабаў зрабіць гэты наступны крок. Вы можаце выпісаць электронную канфігурацыю высакароднага газу, а затым замяніць гэтую ж канфігурацыю ў цікавіць вас элеменце. Альтэрнатывай з'яўляецца выдаленне той самай колькасці электронаў, якую мае высакародны газ, з элемента, для якога вы пішаце канфігурацыю.
Заменіце высакародны газ той жа колькасцю электронаў, што і высакародны газ. Ёсць некалькі спосабаў зрабіць гэты наступны крок. Вы можаце выпісаць электронную канфігурацыю высакароднага газу, а затым замяніць гэтую ж канфігурацыю ў цікавіць вас элеменце. Альтэрнатывай з'яўляецца выдаленне той самай колькасці электронаў, якую мае высакародны газ, з элемента, для якога вы пішаце канфігурацыю. - Напрыклад, натрый мае 11 электронаў, а неон - 10 электронаў.
- Поўная канфігурацыя электрона для натрыю: 1s22p3s і неонавая 1s22p. Як бачыце, у натрыю 3s, а ў неона - няма, таму канфігурацыя высакароднага газу для натрыю становіцца [Ne] 3s.
- Акрамя таго, вы можаце лічыць падрадковыя знакі энергетычных паказчыкаў, пакуль у вас не атрымаецца дзесяць. Выдаліце гэтыя ўзроўні энергіі і не кажучы ўжо пра тое, што засталося. Калі вы выкарыстоўваеце неон для напісання электроннай канфігурацыі натрыю, у вас застаецца адзін электрон: [Ne] 3s.
Папярэджанні
- Толькі ў нейтральным атаме атамны нумар роўны колькасці электронаў. Іён змяшчае розную колькасць электронаў. Калі іён мае зарад -1, у яго ёсць адзін дадатковы электрон. Зарад -2 мае два дадатковыя электроны і г.д.