Аўтар:
Randy Alexander
Дата Стварэння:
1 Красавік 2021
Дата Абнаўлення:
1 Ліпень 2024
Задаволены
У хіміі, валентныя электроны - гэта электроны, размешчаныя ў самым вонкавым пласце электроннай абалонкі элемента. Вызначэнне колькасці валентных электронаў элемента з'яўляецца важным метадам у хіміі, таму што гэтая інфармацыя дапаможа вызначыць тыпы сувязяў, якія можа ўтвараць гэты элемент. Вызначэнне колькасці валентных электронаў лёгка зрабіць з дапамогай перыядычнай сістэмы хімічных элементаў.
Крокі
Частка 1 з 2: Знайдзіце колькасць валентных электронаў, выкарыстоўваючы перыядычную сістэму
З непераходным металам
Ёсць адзін гатовы перыядычная сістэма хімічныя элементы. Перыядычная табліца элементаў (скарочана перыядычная табліца) - гэта шматколесная табліца з каляровай кадоўкай, якая пералічвае ўсе вядомыя элементы, а таксама некаторую неабходную інфармацыю пра гэтыя элементы. На падставе даступнай інфармацыі ў перыядычнай табліцы мы можам вызначыць колькасць валентных электронаў элемента, які мы даследуем. Табліца Мендзялеева звычайна прыкладаецца да падручніка. Вы таксама можаце звярнуцца да гэтай існуючай інтэрактыўнай табліцы Мендзялеева.

Кожны слупок перыядычнай табліцы нумаруйце ад 1 да 18. Звычайна ў перыядычнай сістэме ўсе элементы ў адным слупку будуць мець аднолькавую колькасць валентных электронаў. Калі ў вашай перыядычнай табліцы яшчэ не пранумараваны слупкі, зрабіце гэта самастойна, пранумараваўшы з 1 па 18 вертыкальна злева направа. Па-навуковаму кожны слупок перыядычнай сістэмы называецца адным "група".- Напрыклад, для перыядычнай табліцы без знака мы паставім нумар 1 над элементам Вадарод (H), нумар 2 над элементам Beri (Be) і будзем рабіць тое самае да 18 над геліем (He ).

Вызначце становішча разгляданага элемента. На гэтым этапе вызначыце становішча элемента, які вы разглядаеце, у перыядычнай табліцы. Вы можаце знайсці становішча элемента на аснове яго хімічнага сімвала (літара ў кожнай ячэйцы), атамнага нумара (нумара ў левым верхнім куце кожнай ячэйкі) альбо на аснове інфармацыі паведамленні даступныя ў перыядычнай табліцы.- Напрыклад, нам трэба знайсці колькасць валентных электронаў элемента Вуглярод (З). Атамны нумар элемента роўны 6. Вуглярод знаходзіцца ў верхняй частцы элементаў групы 14. На наступным этапе мы вызначым колькасць валентных электронаў гэтага элемента.
- У гэтым раздзеле мы будзем ігнараваць пераходныя металы, гэта значыць элементы ў дыяпазоне груп ад 3 да 12. Гэтыя пераходныя металы некалькі адрозніваюцца ад астатніх, таму этапы Інструкцыі, прыведзеныя ў гэтым раздзеле, не распаўсюджваюцца на такія металы. Мы разгледзім гэтыя групы элементаў далей у артыкуле.

Выкарыстоўвайце нумар групы для вызначэння колькасці валентных электронаў. Нумар групы непераходнага металу можна выкарыстоўваць для вылічэння колькасці валентных электронаў у атаме гэтага элемента. "Адзінкавы радок нумара групы" - гэта колькасць валентных электронаў, якія прысутнічаюць у атамах элементаў гэтай групы. Іншымі словамі:- Група 1: 1 валентны электрон
- Група 2: 2 валентныя электроны
- Група 13: 3 валентныя электроны
- Група 14: 4 валентныя электроны
- Група 15: 5 валентных электронаў
- Група 16: 6 валентных электронаў
- Група 17: 7 валентных электронаў
- Група 18: 8 валентных электронаў (за выключэннем гелія з 2 валентнымі электронамі)
- У прыкладзе вугляроду, паколькі вуглярод уваходзіць у групу 14, можна сказаць, што атам вугляроду ёсць чатыры валентныя электроны.
З пераходным металам
Вызначце элемент у дыяпазоне ад групы 3 да групы 12. Як ужо згадвалася вышэй, элементы з 3 па 12 групы называюцца "пераходнымі металамі", і калі гаворка ідзе пра валентныя электроны, яны маюць розныя ўласцівасці, чым астатнія. У гэтым раздзеле мы даведаемся, чаму часта немагчыма прысвоіць валентныя электроны атамам пераходных металаў.
- У гэтым раздзеле мы возьмем у якасці прыкладу элемент Тантан (Ta), атамны нумар якога складае 73. Наступныя крокі дапамогуць вызначыць колькасць валентных электронаў элемента.
- Звярніце ўвагу, што элементы трох сямействаў лантан і актыній (таксама вядомыя як "рэдказямельныя металы") таксама адносяцца да групы пераходных металаў - гэтыя дзве групы элементаў звычайна пералічаны ніжэй перыядычнай табліцы. галава з лантан і актыні.
Валентныя электроны ў пераходных металах - гэта не тое самае, што "звычайныя" валентныя электроны. Каб зразумець, чаму пераходныя металы на самай справе не "працуюць", як іншыя элементы перыядычнай табліцы, нам трэба ведаць крыху пра тое, як электроны працуюць у атаме, як тлумачыцца ніжэй. , альбо вы можаце прапусціць гэты крок.
- Калі электроны ўстаўляюцца ў атам, яны размяшчаюцца па розных "арбіталях" - розных абласцях вакол ядра. Карацей кажучы, валентныя электроны - гэта электроны, размешчаныя на самай вонкавай арбітале - іншымі словамі, апошнія электроны, дададзеныя да атама.
- Падрабязна тлумачыць арбіталу, магчыма, трохі складана, калі ў падклас дадаюцца электроны d атамнай абалонкі пераходнага металу (гл. ніжэй), першы з гэтых электронаў будзе паводзіць сябе як звычайныя валентныя электроны, але потым іх уласцівасці могуць змяніцца ўдвая калі электроны з іншых арбіталяў могуць дзейнічаць як валентныя электроны. Гэта значыць, атам можа мець некалькі валентных электронаў у залежнасці ад выпадку.
- Вы можаце даведацца больш пра гэта на сайце валентных электронаў Clackamas Community College.
Вызначце колькасць валентных электронаў, зыходзячы з ліку групы. Як адзначалася вышэй для непераходных металаў, нумар групы ў перыядычнай сістэме можа дапамагчы вызначыць колькасць валентных электронаў. Аднак дакладнай формулы для вызначэння дакладнай колькасці валентных электронаў пераходнага металу няма - у гэтым выпадку колькасць валентных электронаў элемента знаходзіцца не на фіксаванай велічыні, а на колькасці рэчаў. самагрупы могуць сказаць толькі адносную колькасць валентных электронаў. Падрабязна:
- Група 3: 3 валентныя электроны
- Групы з 4: 2 - 4 валентных электронаў
- Група 5: ад 2 да 5 валентных электронаў
- Група 6: ад 2 да 6 валентных электронаў
- Групы 7: ад 2 да 7 валентных электронаў
- Групы з 8: 2 - 3 валентных электронаў
- Групы 9: ад 2 да 3 валентных электронаў
- Групы з 10: 2 - 3 валентных электронаў
- Групы 11: 1 - 2 валентныя электроны
- Група 12: 2 валентныя электроны
- На прыкладзе элемента Tanta (Ta) групы 5 можна сказаць, што гэты элемент мае ад 2 да 5 валентных электронаў, у залежнасці ад выпадку.
Частка 2 з 2: Знайдзіце колькасць валентных электронаў на аснове канфігурацыі электронаў
Даведайцеся, як чытаць электронную канфігурацыю. Зыходзячы з электроннай канфігурацыі элемента, мы можам таксама вызначыць колькасць валентных электронаў гэтага элемента. Канфігурацыя электронаў выглядае складана, але гэта проста тое, як адлюстраваць арбіталі элемента ў выглядзе літар і лічбаў, як толькі вы зразумееце закон, зразумець канфігурацыю электрона не складзе працы.
- Разгледзім прыклад канфігурацыі электрона натрыю (Na):
- 1s2s2p3s
- Калі вы звернеце ўвагу, вы ўбачыце, што электронная канфігурацыя - гэта проста радок паўтораў:
- (нумар) (слова) (лік) (слова) ...
- ... і гэтак далей. Група (нумар) (слова) першы - гэта назва арбіты і абазначае колькасць электронаў на гэтай арбітале.
- Такім чынам, у нашым выпадку мы можам сказаць, што натрый мае 2 электроны на 1s арбітале, 2 электроны на арбіце 2s, 6 электронаў на арбіце 2р і 1 электрон на 3-х арбітах. Усяго 11 электронаў - атамны нумар натрыю таксама 11.
- Разгледзім прыклад канфігурацыі электрона натрыю (Na):
Знайдзіце электронную канфігурацыю элемента, які вы разглядаеце. Пасля таго, як вы ведаеце электронную канфігурацыю элемента, знайсці электронную канфігурацыю гэтага элемента не складзе працы (за выключэннем выпадкаў пераходных металаў). Калі ў пытанні, якое трэба вырашыць, даступная электронная канфігурацыя, вы можаце прапусціць гэты крок. Калі вам трэба знайсці электронную канфігурацыю, выканайце наступныя дзеянні:
- Поўная электронная канфігурацыя элемента ununocti (Uuo), атамны нумар 118:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Пасля таго, як вы атрымаеце такую поўную канфігурацыю электронаў, каб знайсці электронную канфігурацыю іншага элемента, вам проста трэба запоўніць арбіталы электронамі, пачынаючы з першай арбіталы, пакуль колькасць электронаў не скончыцца для запаўнення. Гэта гучыць складана, але калі справа даходзіць да гэтага, гэта адносна проста. Напрыклад, калі б мы хацелі напісаць поўную электронную канфігурацыю хлору (Cl), элемента 17, гэта значыць атам гэтага элемента мае 17 электронаў, мы б запоўнілі наступнае:
- 1s2s2p3s3p
- Звярніце ўвагу, што агульная колькасць электронаў у электроннай канфігурацыі дакладна падыходзіць 17: 2 + 2 + 6 + 2 + 5 = 17. Вам проста трэба змяніць лік на апошняй арбітале - астатняе застаецца ранейшым, таму што амаль перадапошняя арбіталя поўная. электрон.
- Даведайцеся больш пра тое, як напісаць электронную канфігурацыю элемента.
- Поўная электронная канфігурацыя элемента ununocti (Uuo), атамны нумар 118:

Размясціце электроны на арбіталях у адпаведнасці з Восьмым правілам. Калі электроны дадаюцца да атама, яны сартуюцца на арбіталі ў парадку, указаным вышэй - першыя два электроны будуць размешчаны ў 1s-арбітале, наступныя два электроны ў 2s-арбітале, наступныя шэсць электронаў размешчаны ў арбітале 2р, рабіце так, пакуль электрон не размесціцца на адпаведнай арбітале. Калі мы разглядаем атамы непераходных элементаў, мы можам сказаць, што гэтыя арбіталі будуць утвараць "ярусы" вакол ядра, у якіх наступны пласт будзе знаходзіцца далей ад ядра, чым той, які быў да яго. У дадатак да першага арбітальнага пласта, які можа ўтрымліваць толькі два электроны, усе наступныя арбітальныя пласты могуць утрымліваць да васьмі электронаў (за выключэннем пераходных металаў). Гэтае правіла называецца Васьмікратнае правіла.- Напрыклад, разгледзім элемент Bo (B). Атамны нумар гэтага элемента роўны 5, таму мы маем электронную канфігурацыю гэтага элемента наступным чынам: 1s2s2p. Паколькі першая арбітальная абалонка змяшчае толькі 2 электроны, можна вызначыць, што Бо мае два арбітальныя пласты: першы складаецца з 2 электронаў на 1s арбітале, а другі з трыма электронамі, размеркаванымі на 2s і 2p арбіталях. .
- У іншым прыкладзе элемент, падобны на хлор, будзе мець 3 пласта: пласт з двух электронаў на арбітале 1s, пласт з двух электронаў на арбітале 2s і шэсць электронаў на арбітале 2p і знешні пласт з двух электронаў на арбіце 3s. і пяць электронаў на арбіце 3р.

Знайдзіце колькасць электронаў у самым вонкавым пласце. Пасля вызначэння электроннай канфігурацыі мы ўжо ведаем пласты гэтага элемента, знайсці колькасць валентных электронаў можна, вызначыўшы колькасць электронаў у самым вонкавым пласце атамнай электроннай абалонкі. Калі крайні пласт поўны (г.зн. ужо ў агульнай складанасці восем электронаў, альбо для першага пласта 2 электроны), гэты элемент называецца інертным элементам і амаль не ўдзельнічае ў хімічных рэакцыях. Аднак гэта правіла не распаўсюджваецца на пераходныя металы.- Напрыклад, з элементам Bo, паколькі Bo мае тры электроны ў другім пласце, таксама самым вонкавым пласце, можна сказаць, што элемент Bo мае бацька валентныя электроны.

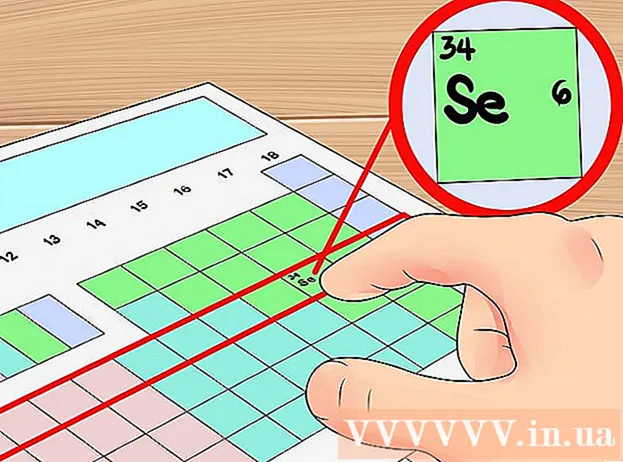
Выкарыстоўвайце нумар радка ў перыядычнай сістэме як скарочаны спосаб вызначэння колькасці арбітальных слаёў. Выклікаецца гарызантальны радок у перыядычнай сістэме "цыкл" з элементаў. Пачынаючы з першага радка, кожны цыкл адпавядае "колькасці электронных слаёў" элементаў за той самы перыяд. Такім чынам, вы можаце выкарыстоўваць перыяд для хуткага вызначэння колькасці валентных электронаў элемента - вы проста падлічваеце колькасць электронаў па парадку злева направа ад першага элемента гэтага перыяду. Яшчэ раз адзначым, што гэта не датычыцца пераходных металаў.- Напрыклад, паколькі селен належыць да цыкла 4, можна вызначыць, што элемент мае чатыры электронныя пласты ў атамнай абалонцы. Паколькі злева направа гэта шосты элемент у цыкле 4 (за выключэннем пераходнага металу), можна сказаць, што чацвёртая абалонка селену мае шэсць электронаў, гэта значыць гэты элемент мае шэсць валентных электронаў.
Парада
- Звярніце ўвагу, электронная канфігурацыя можа быць коратка напісана з выкарыстаннем рэдкіх газаў (элементы групы 18) замест арбіталяў у верхняй частцы канфігурацыі. Напрыклад, электронную канфігурацыю натрыю можна запісаць як 3s1 - гэта значыць, электронная канфігурацыя натрыю такая ж, як у Неона, але ў арбітале 3s ёсць дадатковы электрон.
- Пераходныя металы могуць мець няпоўныя валентныя падкласы. Для дакладнага вызначэння валентнага ліку пераходнага металу неабходна выкарыстоўваць складаныя квантавыя прынцыпы, якія не разглядаюцца гэтым артыкулам.
- Таксама важна адзначыць, што ў розных краінах перыядычная сістэма хімічных элементаў можа быць рознай. Такім чынам, пераканайцеся, што вы карыстаецеся агульнай перыядычнай сістэмай, дзе вы жывяце, каб пазбегнуць блытаніны.
Што вам трэба
- Перыядычная сістэма хімічных элементаў
- Аловак
- Папера