Аўтар:
Randy Alexander
Дата Стварэння:
25 Красавік 2021
Дата Абнаўлення:
26 Чэрвень 2024
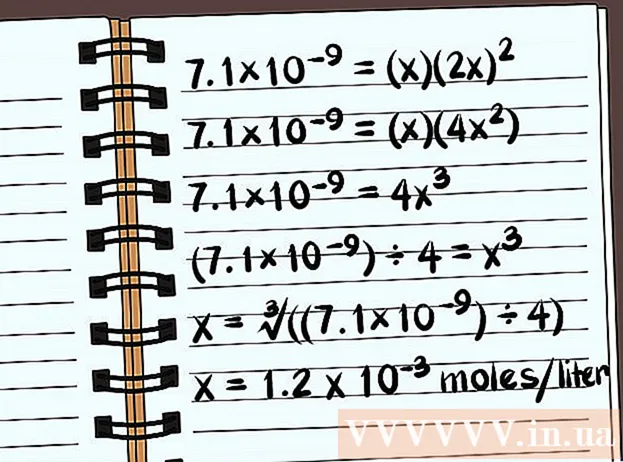
Задаволены
У хіміі растваральнасць выкарыстоўваецца для апісання ўласцівасцей цвёрдага злучэння, калі яно цалкам раствараецца ў вадкасці, не пакідаючы нерастваральных рэшткаў. Раствараюцца толькі іённыя злучэнні (зараджаныя). На самай справе вам трэба толькі запомніць некалькі прынцыпаў альбо паглядзець літаратуру, каб даведацца, ці застанецца іённае злучэнне цвёрдым пры даданні ў ваду, альбо растворыцца вялікая колькасць. На самай справе, пэўная колькасць малекул раствараецца, нават калі вы не бачыце ніякіх змен, таму, каб эксперымент быў дакладным, вы павінны ведаць, як вылічыць гэтую колькасць растворанага рэчыва.
Крокі
Спосаб 1 з 2: Выкарыстоўвайце хуткія правілы
Даведайцеся пра іённыя злучэнні. У кожнага атама звычайна ёсць пэўная колькасць электронаў, але часам ён атрымлівае ці аддае электрон. Гэты працэс робіць яго адзіным іёны зараджана. Калі іён з адмоўным зарадам (з лішкам аднаго электрона) сутыкнецца з іонам з станоўчым зарадам (не хапае электрона), яны злучацца, як катод і анод двух магнітаў. У выніку ўтвараецца іённае злучэнне.
- У іёнаў называецца адмоўны зарад аніёны, і іёны называюць станоўчым зарадам катыён.
- Звычайна колькасць электронаў у атаме роўна колькасці пратонаў, таму ў ім няма зарада.

Зразумець растваральнасць. Малекула вады (H2О) мае няправільную структуру, таму нагадвае магніт: адзін канец мае станоўчы зарад, а другі - адмоўны. Калі вы кладзеце ў ваду іённае злучэнне, гэтыя вадзяныя "магніты" збіраюцца вакол яго, спрабуючы разабраць станоўчыя і адмоўныя іёны.- Некаторыя іённыя злучэнні не вельмі шчыльна ўбіраюцца, яны разглядаюцца растваральны Таму што ён будзе расколвацца і растварацца пры даданні ў ваду. Іншыя злучэнні маюць больш трывалыя сувязі нерастваральны таму што іёны шчыльна прыцягваюцца адзін да аднаго незалежна ад прыцягнення малекулы вады.
- Некаторыя злучэнні валодаюць сілай звязвання, эквівалентнай прыцягненню малекулы вады. Яны разглядаюцца слаба раствараецца таму што большасць злучэнняў будзе падзелена, а астатнія ўсё роўна будуць прыцягвацца адзін да аднаго.

Зразумець прынцып роспуску. Паколькі ўзаемадзеянне паміж атамамі настолькі складанае, вы не можаце цалкам спадзявацца на інтуіцыю, каб адрозніць, якія злучэнні могуць ці не могуць. Знайдзіце першы іён у злучэнні ў спісе ніжэй, каб даведацца пра яго агульныя ўласцівасці, а затым праверце выключэнні, каб пераканацца, што другі іён не ўзаемадзейнічае з ім анамальна.- Напрыклад, для праверкі хларыду стронцыю (SrCl2), калі ласка, шукайце Sr або Cl у тоўстых кроках ніжэй. Cl "звычайна раствараецца", таму праверце выключэнні ніжэй. Sr не ўваходзіць у спіс выключэнняў, таму SrCl2 павінна быць растваральнай.
- Самыя распаўсюджаныя выключэнні з кожнага правіла напісаны ніжэй за правіла. Ёсць і іншыя выключэнні, але яны наўрад ці могуць адбыцца падчас звычайнай хіміі альбо лабараторных гадзін.

Злучэнні раствараюцца, калі ўтрымліваюць шчолачныя металы, такія як Li, Na, K, Rb і Cs. Гэтыя металы таксама вядомыя як элементы групы IA: літый, натрый, калій, рубідый і цэзій. Амаль усе злучэнні, якія змяшчаюць адзін з гэтых іёнаў, растваральныя.- Выключэнне: Лі3PO4 неразрыўны.
НЯМА злучэнняў3, З2Н3О2, НЕ2, ClO3 і ClO4 усе растваральныя. Назвы, якія адпавядаюць названым вышэй іёнам, - нітрат, ацэтат, нітрыт, хларат і перхларат. Звярніце ўвагу, што ацэтат часта скарачаюць як OAc.
- Выключэнне: Ag (OAc) (ацэтат срэбра) і Hg (OAc)2 (ацэтат ртуці) нерастваральны.
- AgNO2 і KClO4 толькі "злёгку растала".
Злучэння Cl, Br і I звычайна растваральныя. Іёны хларыдаў, брамідаў і ёдыдаў амаль заўсёды ўтвараюць растваральныя злучэнні, якія называюцца галогенавымі солямі.
- Выключэнне: Калі які-небудзь з вышэйпералічаных іёнаў злучаецца з іёнамі срэбра Ag, ртуць Hg2, або Pb свінец, утвараюць нерастваральныя злучэнні. Тое ж тычыцца і менш распаўсюджаных злучэнняў, якія ўтвараюцца пры спалучэнні з меддзю Cu і талі Tl.
Злучэнні, якія змяшчаюць SO4 звычайна раствараецца. Іёны сульфатаў часта ўтвараюць растваральныя злучэнні, але ёсць шмат выключэнняў.
- Выключэнне: Сульфатныя іёны ўтвараюць нерастваральнае злучэнне з наступнымі іёнамі: стронцый Sr, барый Ba, свінец Pb, срэбра Ag, кальцый Ca, радый Ra і срэбра monatom Ag2. Звярніце ўвагу, што сульфат срэбра і сульфат кальцыя раствараюцца толькі ўмерана, таму некаторыя людзі лічаць іх маларастваральнымі.
Рэчывы, якія змяшчаюць OH або S, нерастваральныя. Адпаведныя назвы гэтых іёнаў - гідраксіды і сульфіды.
- Выключэнне: Вы памятаеце шчолачныя металы (групы I-A) і як яны любяць утвараць растваральныя злучэнні? Усе Li, Na, K, Rb і Cs ўтвараюць злучэнні, растваральныя з гідраксіднымі або сульфіднымі іёнамі. Акрамя таго, гідраксіды ўтвараюць солі, растваральныя ў іёнах шчолачназямельных металаў (II-A група): кальцый Ca, стронцый Sr і барый Ba. Заўвага: злучэнні, зробленыя з гідраксідаў і шчолачназямельных металаў, на самай справе маюць значную колькасць малекул, якія застаюцца звязанымі паміж сабой, таму іх часам лічаць "слабарастваральнымі".
СА-змяшчаюць злучэнні3 альбо PO4 неразрыўны. У апошні раз праверце наяўнасць іёнаў карбанату і фасфатаў, і вы ўбачыце, раствараецца Ці ваша злучэнне.
- Выключэнне: Гэтыя іёны ўтвараюць злучэнні, растваральныя з такімі шчолачнымі металамі, як Li, Na, K, Rb і Cs, а таксама з іёнам амонія NH4.
Спосаб 2 з 2: Вылічыце растваральнасць з канстанты Kсп
Знайдзіце канстанту прадукту растваральнасці Kсп. Гэтая канстанта адрозніваецца для кожнага злучэння, таму вы павінны шукаць яе на графіцы ў падручніку альбо ў Інтэрнэце. Паколькі гэтыя значэнні вызначаюцца эксперыментальна і могуць істотна адрознівацца ў залежнасці ад графікаў, лепш выкарыстоўваць графік падручніка, калі ён ёсць. Калі не пазначана іншае, большасць участкаў мяркуе выпрабавальную тэмпературу 25 ° C.
- Напрыклад, скажам, вы раствараеце ёдыд свінцу формулай PbI2, запішыце канстанту яго растваральнасці. Калі вы спасылаецеся на графік на bilbo.chm.uri.edu, вы выкарыстоўваеце канстанту 7,1 × 10.
Напішыце хімічнае ўраўненне. Па-першае, вызначыць іённую схему падзелу гэтага злучэння пры растварэнні. Затым запішыце ўраўненне з Kсп з аднаго боку і іёны кампанентаў з другога.
- Напрыклад, малекула PbI2 дысацыяваць на іёны Pb, I і I. (Вам трэба толькі ведаць ці правяраць зарад іона, бо ўсе злучэнні заўсёды электрычна нейтральныя).
- Запішыце ўраўненне 7,1 × 10 =
- Гэта ўраўненне - канстанта растваральнасці, якую вы можаце даведацца для 2 іёнаў у табліцы растваральнасці. Паколькі ёсць 2 l- іёнаў, l- павінен быць квадратным.
Пераўтварыце ўраўненні, каб выкарыстоўваць зменныя. Перапішыце ўраўненне, выкарыстоўваючы звычайныя алгебраічныя метады, выкарыстоўваючы вядомую вам інфармацыю пра колькасць малекул і іёнаў. Усталюйце х, роўную масе злучэння, якое павінна растварыцца, і перапішыце ўраўненне, дзе х - лік кожнага іёна.
- У гэтым прыкладзе нам трэба перапісаць ураўненне 7,1 × 10 =
- Паколькі ў злучэнні толькі адзін іён свінцу (Pb), колькасць раствораных малекул роўна колькасці свабодных іёнаў свінцу. Такім чынам, мы можам усталяваць яго ў х.
- Паколькі на кожны іён свінцу прыпадае два іёны ёду (I), мы ўсталёўваем колькасць атамаў ёду, роўнае 2x.
- Цяпер ураўненне становіцца 7.1 × 10 = (x) (2x)
Прыміце пад увагу агульныя іёны, калі такія маюцца. Прапусціце гэты этап, калі вы раствараеце злучэнне ў дыстыляванай вадзе. Калі злучэнне растворыць у растворы, які ўжо мае адзін або некалькі іёнаў кампанента ("агульныя іёны"), растваральнасць злучэння значна паменшыцца. Эфект агульных іёнаў будзе найбольш відавочны на практычна нерастваральных злучэннях, і ў гэтым выпадку можна выказаць здагадку, што большасць іёнаў у раўнавазе - гэта тыя, якія раней знаходзіліся ў растворы. Перапішыце ўраўненне, каб вылічыць малярную канцэнтрацыю (моль на літр альбо М) іёнаў, якія ўжо знаходзяцца ў растворы, замяніўшы гэта значэнне зменнай х, якую вы выкарыстоўваеце для гэтага іёна.
- Напрыклад, калі злучэнне ёдыду свінцу раствараюць у 0,2М растворы хларыду свінцу (PbCl)2), мы перапішам ураўненне ў выглядзе 7,1 × 10 = (0,2M + x) (2x). Паколькі 0,2M з'яўляецца больш высокай канцэнтрацыяй, чым x, мы маглі б перапісаць яе на 7,1 × 10 = (0,2M) (2x).
Рашы ўраўненне. Рашыце на х, і вы ўбачыце растваральнасць злучэння. У вызначэнні канстанты растваральнасці вы павінны напісаць свой адказ з пункту гледжання колькасці раствараных моляў злучэння на літр вады. Магчыма, вам давядзецца скарыстацца камп'ютэрам, каб знайсці канчатковы адказ.
- Наступны прыклад - растваральнасць у дыстыляванай вадзе без якіх-небудзь агульных іёнаў.
- 7,1 × 10 = (x) (2x)
- 7,1 × 10 = (х) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = х
- x = ∛ ((7,1 × 10) ÷ 4)
- х = 1,2 х 10 радзімак на літр раствараецца. Гэта вельмі невялікая маса, таму гэта злучэнне практычна не раствараецца.
Што вам трэба
- Табліца канстант растваральнасці прадукту злучэння (Kсп)
Парада
- Калі ў вас ёсць эксперыментальныя дадзеныя аб колькасці раствораных злучэнняў, вы можаце выкарыстоўваць тое ж самае ўраўненне для вырашэння канстанты растваральнасці К.сп.
Папярэджанне
- Няма адзінага меркавання адносна азначэнняў гэтых тэрмінаў, але хімікі сыходзяцца ў меркаванні адносна большасці злучэнняў. Шэраг спецыяльных злучэнняў, у якіх растваральныя і нерастваральныя малекулы складаюць значныя складнікі, кожны з якіх мае іншае апісанне гэтых злучэнняў.
- Некаторыя старыя падручнікі бачаць NH4OH - растваральнае злучэнне. Гэта няпраўда; Выяўлены невялікія колькасці іёнаў NH4 і ОН, але гэтыя два іёны не могуць аб'ядноўвацца ў злучэнні.