Аўтар:
Lewis Jackson
Дата Стварэння:
12 Травень 2021
Дата Абнаўлення:
1 Ліпень 2024
Задаволены
Электронная канфігурацыя атама - гэта шэраг лікаў, якія прадстаўляюць электронныя арбіталі. Электронныя абітаны - гэта прасторавыя вобласці рознай формы, якія атачаюць ядро атама, у якіх электроны размешчаны ўпарадкавана. З дапамогай электроннай канфігурацыі вы можаце хутка вызначыць, колькі электронных арбіталей знаходзіцца ў атаме, і колькасць электронаў на кожнай арбітале. Пасля таго, як вы зразумееце асноўныя прынцыпы канфігурацыі электронаў, вы зможаце напісаць уласную канфігурацыю электронаў і зможаце з упэўненасцю праводзіць хімічныя выпрабаванні.
Крокі
Спосаб 1 з 2: Вызначыце колькасць электронаў пры дапамозе хімічнай перыядычнай сістэмы
Знайдзіце атамны нумар атама. Кожны атам мае пэўную колькасць электронаў, звязаных з ім. Знайдзіце элемент у перыядычнай табліцы. Атамны нумар - натуральны натуральны лік, які пачынаецца з 1 (для вадароду) і пасля гэтага павялічваецца на 1 для кожнага атама. Атамны нумар - гэта колькасць пратонаў атама - значыць, гэта і колькасць электронаў атама ў асноўным стане.
- Вызначце зарад атама. Электрычна нейтральны атам мае правільную колькасць электронаў, як паказана ў перыядычнай табліцы. Аднак атам з зарадам будзе мець больш ці менш электронаў у залежнасці ад яго велічыні зарада. Калі вы працуеце з атамамі з зарадам, дадайце або адніміце адпаведную колькасць электронаў: дадайце адзін электрон для кожнага адмоўнага зарада і адніміце адзін электрон для кожнага станоўчага зарада.
- Напрыклад, у атама натрыю з зарадам +1 адзін электрон будзе выдалены з асноўнага атамнага нумара 11. Такім чынам, у атаме натрыю будзе ў агульнай складанасці 10 электронаў.
- Запомні асноўны арбітальны спіс. Калі атам атрымлівае электроны, яны будуць размешчаны на арбіталях у пэўным парадку. Калі электроны запаўняюць арбіталі, колькасць электронаў на кожнай арбітале цотная. Мы маем наступныя арбіталы:
- Абітан с (любы лік са знакам "s" у электроннай канфігурацыі) мае толькі адну арбіталу і наступны Прынцып, акрамя ПаўліКожная арбітала ўтрымлівае максімум 2 электроны, таму кожная s арбіталы змяшчае толькі 2 электроны.
- Абітан р мае 3 арбіталі, таму можа ўтрымліваць да 6 электронаў.
- Абітан d мае 5 арбіталяў, таму можа ўтрымліваць да 10 электронаў.
- Абітан ф мае 7 арбіталяў, таму можа ўтрымліваць да 14 электронаў. Запомніце парадак арбіталяў у адпаведнасці з наступным кідкім прапановай:
Sдалей Пагрэсіўны Dэ-э FДобра Gздранцвенне ННа жаль ÍДаЯ прыходжу.
Для атамаў з большай колькасцю электронаў арбіталі працягваюць пісацца ў алфавітным парадку пасля літары k, пакідаючы знакі, якія былі выкарыстаны.
- Зразумець канфігурацыю электронаў. Электронныя канфігурацыі напісаны так, каб наглядна паказваць колькасць электронаў у атаме, а таксама колькасць электронаў на кожнай арбітале. Кожная арбітала пішацца ў пэўным парадку, колькасць электронаў на кожнай арбітале пішацца ўверсе справа ад назвы арбіты. Нарэшце, электронная канфігурацыя - гэта паслядоўнасць, якая складаецца з назваў арбіталяў і колькасці электронаў, напісаных вышэй справа ад іх.
- Наступны прыклад - простая электронная канфігурацыя: 1с 2с 2р. Гэтая канфігурацыя паказвае, што на арбітале 1s ёсць два электроны, на арбітале 2s два электроны і на арбіце 2p шэсць электронаў. 2 + 2 + 6 = 10 электронаў (усяго). Гэтая электронная канфігурацыя прызначана для электрычна нейтральнага атама неона (атамны нумар неона складае 10).
- Запомніце парадак арбіталяў. Звярніце ўвагу, што арбіталы пранумараваны ў адпаведнасці з класам электронаў, але энергетычна ўпарадкаваны. Напрыклад, арбітала 4s насычана меншай энергіяй (альбо больш трывалай), чым насычаная альбо ненасычаная арбіталя 3D, таму падклас 4s пішацца першым. Даведаўшыся парадак арбіталяў, вы можаце размясціць у іх электроны ў залежнасці ад колькасці электронаў у атаме. Парадак размяшчэння электронаў на арбіталях наступны: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
- Электронная канфігурацыя атама з кожнай запоўненай электронамі арбіталай пішацца так: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Звярніце ўвагу, што калі ўсе пласты запоўненыя, вышэйапісаная электронная канфігурацыя складаецца з Og (Oganesson), 118, які з'яўляецца самым нумараваным атамам перыядычнай табліцы, які змяшчае ўсе вядомыя ў наш час электронныя пласты для з электрычна нейтральным атамам.
- Сартуйце электроны на арбіталы ў залежнасці ад колькасці электронаў у вашым атаме. Напрыклад, калі вы хочаце напісаць электронную канфігурацыю электрычна нейтральнага атама кальцыя, перш за ўсё трэба знайсці яго атамны нумар у перыядычнай табліцы. Атамны нумар кальцыя складае 20, таму мы напішам канфігурацыю атама з 20 электронамі ў парадку вышэй.
- Размясціце свае электроны на арбіталях у парадку вышэй, пакуль не дасягне 20 электронаў. Абітан 1s атрымлівае два электроны, 2s атрымлівае два, 2p атрымлівае шэсць, 3s атрымлівае два, 3p атрымлівае шэсць і 4s атрымлівае два (2 + 2 + 6 +2 +6 + 2 = 20). Такім чынам, электронная канфігурацыя кальцыя: 1s 2s 2p 3s 3p 4s.
- Заўвага: Узровень энергіі мяняецца па меры павелічэння пласта электронаў. Напрыклад, калі вы пішаце на 4-ы энергетычны ўзровень, спачатку пішацца падклас 4s, пазней да 3d. Пасля напісання чацвёртага энергетычнага ўзроўню вы пяройдзеце на пяты ўзровень і зноў запусціце парадак напластавання. Гэта адбываецца толькі пасля 3-га ўзроўню энергіі.
- Выкарыстоўвайце перыядычную табліцу ў якасці візуальнага цэтліка. Магчыма, вы заўважылі, што форма перыядычнай сістэмы адпавядае парадку арбіталяў у электроннай канфігурацыі. Напрыклад, атамы ў другім левым слупку заўсёды заканчваюцца на "s", атамы на правым баку сярэдняга раздзела заўсёды заканчваюцца на "d" і г. д. Выкарыстоўвайце перыядычную табліцу для запісу структур. лічба - парадак размяшчэння электронаў на арбіталях будзе адпавядаць пазіцыям, паказаным у перыядычнай табліцы. Глядзі ніжэй:
- Два крайнія левыя слупкі - гэта атамы, электронная канфігурацыя якіх заканчваецца на s-арбітале, правая частка перыядычнай табліцы - гэта атамы з электроннай канфігурацыяй, якая заканчваецца на р-арбітале, сярэдняя частка - атамы, якія заканчваюцца на s-арбітале. d, а ўнізе - атамы, якія заканчваюцца на арбітале f.
- Напрыклад, пішучы электронную канфігурацыю элемента хлор, прывядзіце наступны аргумент: Гэты атам знаходзіцца ў трэцім радку (альбо "перыядзе") перыядычнай табліцы. Ён таксама знаходзіцца ў пятай калонцы арбітальнага блока перыядычнай табліцы. Такім чынам, канфігурацыя электронаў скончыцца ... 3р.
- Асцярожна! Арбітальныя класы d і f у перыядычнай сістэме адпавядаюць узроўням энергіі, адрозным ад перыяду. Напрыклад, першы радок d-арбітальнага блока адпавядае 3-й арбітале, нягледзячы на тое, што ён знаходзіцца ў перыядзе 4, у той час як першы шэраг арбіталы f адпавядае арбітале 4f, нават калі ён знаходзіцца ў перыядзе 6.
- Даведайцеся, як пісаць разборныя электронныя канфігурацыі. Называюцца атамы па правым краі перыядычнай сістэмы рэдкі газ. Гэтыя элементы хімічна вельмі інертныя. Каб скараціць шлях да запісу доўгіх электронных канфігурацый, у квадратных дужках упішыце хімічны сімвал бліжэйшага рэдкага газу, у якім менш электронаў, чым у атама, а затым працягвайце запісваць электронныя канфігурацыі наступных арбіталяў. . Глядзі ніжэй:
- Каб зразумець гэтую канцэпцыю, напішыце прыклад канфігурацыі разваленага электрона. Дапусцім, нам трэба напісаць электронную канфігурацыю для аднаўлення цынку (атамны нумар 30) праз рэдкую канфігурацыю газу. Поўная канфігурацыя электрона цынку: 1s 2s 2p 3s 3p 4s 3d. Аднак звярніце ўвагу, што 1s 2s 2p 3s 3p - гэта канфігурацыя рэдкага аганічнага газу. Проста заменіце гэтую частку абазначэння электронаў цынку агонічным хімічным сімвалам у квадратных дужках ().
- Такім чынам, электронная канфігурацыя цынку кампактная 4s 3d.
Спосаб 2 з 2: Выкарыстанне перыядычнай табліцы ADOMAH

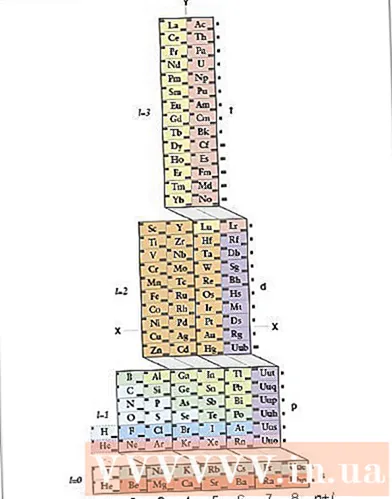
Даследуйце перыядычную сістэму ADOMAH. Гэты спосаб запісу электроннай канфігурацыі не патрабуе запамінання. Аднак гэты метад патрабуе перабудовы перыядычнай сістэмы, бо ў звычайнай перыядычнай сістэме, пачынаючы з чацвёртага радка, колькасць цыклаў не адпавядае электроннаму слою. Знайдзіце перыядычную сістэму ADOMAH, спецыяльную хімічную перыядычную сістэму, распрацаваную навукоўцам Валерым Цімерманам. Вы можаце знайсці гэтую перыядычную табліцу ў Інтэрнэце.- У перыядычнай сістэме ADOMAH гарызантальныя шэрагі ўяўляюць сабой групы элементаў, такія як галагены, інертныя газы, шчолачныя металы, шчолачназямельныя металы і г. д. Вертыкальныя слупкі адпавядаюць слою электронаў і называюцца "прыступкамі" (дыяганальныя злучэння). блокі s, p, d і f) адпавядаюць перыяду.
- Гелій размешчаны побач з вадародам, таму што абодва маюць унікальную арбіталу 1s. Перыядычныя блокі (s, p, d і f) адлюстраваны з правага боку, а колькасць электронных слаёў - у аснове. Імёны элементаў пішуцца ў прамавугольніку з нумарамі ад 1 да 120. Гэтыя лікі - звычайныя атамныя нумары, якія прадстаўляюць агульную колькасць электронаў у электрычна нейтральным атаме.
- Знайдзіце элементы ў перыядычнай сістэме ADOMAH. Каб напісаць электронную канфігурацыю для элемента, знайдзіце яго сімвал у перыядычнай табліцы ADOMAH і выкрэсліце ўсе элементы з больш высокімі атамнымі нумарамі. Напрыклад, калі вы хочаце напісаць электронную канфігурацыю eribi (68), выкрэсліце элементы з 69 па 120.
- Звярніце ўвагу на лічбы з 1 па 8 у аснове перыядычнай табліцы. Гэта колькасць электронных слаёў ці калон. Не звяртайце ўвагі на слупкі, якія маюць толькі выкрэсленыя элементы.Для eribi астатнія слупкі складаюць 1, 2, 3, 4, 5 і 6.
- Падлічыце колькасць арбіталяў да становішча атама, каб напісаць канфігурацыю. Паглядзіце на пазначэнне блока, паказанае справа ад перыядычнай табліцы (s, p, d і f), і паглядзіце колькасць слупкоў, паказаных у аснове табліцы, незалежна ад дыяганальных ліній паміж блокамі, падзяліце слупкі на блокі-калонкі і запішыце яны ў парадку знізу ўверх. Ігнараваць блокі слупкоў, якія змяшчаюць толькі перакрэсленыя элементы. Запішыце блокі-слупкі, пачынаючы з нумара слупка, а затым сімвала блока, напрыклад: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (у выпадку eribi).
- Заўвага: Прыведзеная вышэй канфігурацыя электронаў для Er запісваецца ў парадку ўзрастання колькасці электронных слаёў. Гэтая канфігурацыя таксама можа быць запісана ў парадку размяшчэння электронаў на арбіталях. Пры напісанні блокаў слупкоў выконвайце дзеянні зверху ўніз замест калон: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- Падлічыце колькасць электронаў на арбіталу. Падлічыце колькасць электронаў, якія не выкрэслены ў кожным калонцы-блоку, прызначце па адным электроне на элемент і запішыце колькасць электронаў побач з сімвалам блока для кожнага блока-слупка, напрыклад: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6с. У гэтым прыкладзе гэта электронная канфігурацыя эрыбі.
- Распазнаць ненармальныя канфігурацыі электронаў. Існуе васемнаццаць распаўсюджаных выключэнняў з электроннай канфігурацыі атамаў у самым нізкім энергетычным стане, таксама вядомым як асноўны. У параўнанні з агульным эмпірычным правілам яны адхіляюцца толькі ад апошніх двух да трох электронных пазіцый. У гэтым выпадку фактычная электронная канфігурацыя прымушае электроны мець меншы энергетычны стан, чым стандартная канфігурацыя атама. Незвычайныя атамы:
- Кр (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Мо (..., 4d5, 5s1); Ру (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Аг (..., 4d10, 5s1); Ла (..., 5d1, 6s2); Се (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Аў (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Па (..., 5f2, 6d1, 7s2); У (..., 5f3, 6d1, 7s2); Нп (..., 5f4, 6d1, 7s2) і См (..., 5f7, 6d1, 7s2).
Парада
- Калі атам - іён, гэта азначае, што колькасць пратонаў не роўна колькасці электронаў. Зарад атама потым паказваецца ў (звычайна) правым верхнім куце сімвала элемента. Таму атам сурмы з зарадам +2 будзе мець электронную канфігурацыю 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Звярніце ўвагу, што 5p змяняецца на 5p. Будзьце асцярожныя, калі канфігурацыя электрычна нейтральнага атама сканчаецца на любых арбіталях, акрамя s і p. З выдаленымі электронамі можна браць электроны толькі з валентных арбіталяў (s і p арбіталяў). Такім чынам, калі канфігурацыя заканчваецца 4s 3d, а атам мае зарад +2, канфігурацыя змяняецца 4s 3d. Мы бачым 3dпастаянны, але выдаляюцца толькі электроны ў арбітале s.
- Усе атамы, як правіла, вяртаюцца ў стабільны стан, і найбольш стабільнай электроннай канфігурацыі будзе дастаткова s і p арбіталяў (s2 і p6). Гэтыя рэдкія газы маюць электронную канфігурацыю, таму яны рэдка ўдзельнічаюць у рэакцыях і знаходзяцца ў правым баку перыядычнай сістэмы. Такім чынам, калі канфігурацыя заканчваецца на 3р, трэба толькі дадаць яшчэ два электроны, каб стаць стабільным (выдача шасці электронаў, уключаючы тыя, што знаходзяцца на арбітале, запатрабуе больш энергіі, таму аддаць чатыры электроны будзе проста. прасцей). Калі канфігурацыя заканчваецца на 4d, ёй трэба толькі аддаць тры электроны, каб дасягнуць стабільнага стану. Сапраўды гэтак жа новыя падкласы, якія прымаюць палову электронаў (s1, p3, d5 ..), з'яўляюцца больш стабільнымі, напрыклад, p4 або p2, але s2 і p6 будуць яшчэ больш стабільнымі.
- Вы таксама можаце выкарыстоўваць канфігурацыю валентнага электрона для запісу электроннай канфігурацыі элемента, які з'яўляецца апошняй s і p арбіталямі. Такім чынам, валентная канфігурацыя атама сурмы для сурмы складае 5s 5p.
- Іёны гэтага не любяць, бо яны значна даўгавечней. Прапусціце два вышэйзгаданых этапы гэтага артыкула і працуйце аднолькава, у залежнасці ад таго, з чаго вы пачынаеце і колькі ці менш электронаў у вас ёсць.
- Каб знайсці атамны нумар па яго электроннай канфігурацыі, дадайце ўсе лічбы, якія ідуць пасля літар (s, p, d і f). Гэта правільна толькі ў тым выпадку, калі гэта нейтральны атам, калі гэта іён, вы не можаце выкарыстоўваць гэты метад. Замест гэтага вы павінны скласці альбо адняць колькасць электронаў, якое вы прымаеце альбо аддаяце.
- Лічба пасля літары павінна быць напісана ў правым верхнім куце, вы не павінны пісаць няправільна, калі праходзіце тэст.
- Ёсць два розныя спосабы напісання электронных канфігурацый. Вы можаце запісваць у парадку ўзрастання пласта электронаў альбо ў парадку размяшчэння электронаў на арбіталях, як паказана для атама эрыбі.
- Бываюць выпадкі, калі электрон трэба "падштурхнуць". Гэта значыць, калі на арбітале не хапае толькі аднаго электрона, каб мець палову альбо ўсе электроны, тады вам трэба ўзяць электрон з бліжэйшай арбіты s або p, каб перанесці яго на арбіталу, якая мае патрэбу ў гэтым электроне.
- Нельга сказаць, што "стабільнасць долі энергіі" падкласа атрымлівае палову электронаў. Гэта занадта простае спрашчэнне. Прычына стабільнага энергетычнага ўзроўню новага падкласа, які атрымлівае "палову колькасці электронаў", заключаецца ў тым, што кожная арбіталя мае толькі адзін электрон, таму адштурхванне электрона ад электрона зведзена да мінімуму.