Аўтар:
Bobbie Johnson
Дата Стварэння:
10 Красавік 2021
Дата Абнаўлення:
1 Ліпень 2024
Задаволены
- крокі
- Частка 1 з 2: Падрыхтуйце абсталяванне
- Частка 2 з 2: Правядзіце эксперымент
- парады
- папярэджання
- Што вам спатрэбіцца
Працэс расшчаплення вады (H2O) на яе складнікі (вадарод і кісларод) з дапамогай электрычнасці называецца электролізам. Атрыманыя ў выніку электролізу газы можна выкарыстоўваць самі па сабе - напрыклад, вадарод служыць адным з найчыстых крыніц энергіі. Хоць назва дадзенага працэсу, магчыма, і гучыць некалькі мудрагеліста, на самой справе гэта прасцей, чым можа здацца, калі ў вас ёсць падыходнае абсталяванне, веды і трохі вопыту.
крокі
Частка 1 з 2: Падрыхтуйце абсталяванне
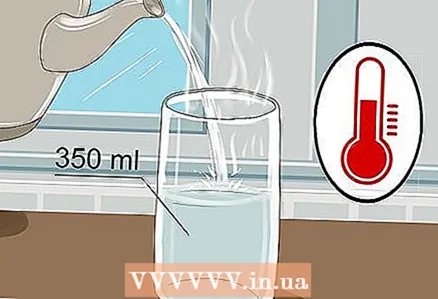 1 Вазьміце шклянку аб'ёмам 350 мілілітраў і наліце ў яго цёплую ваду. Няма неабходнасці запаўняць шклянку да краёў, хопіць невялікай колькасці вады. Падыдзе і халодная вада, хоць цёплая лепш праводзіць электрычнасць.
1 Вазьміце шклянку аб'ёмам 350 мілілітраў і наліце ў яго цёплую ваду. Няма неабходнасці запаўняць шклянку да краёў, хопіць невялікай колькасці вады. Падыдзе і халодная вада, хоць цёплая лепш праводзіць электрычнасць. - Падыдзе як вадаправодная, так і бутэляваная вада.
- Цёплая вада мае меншую глейкасць, дзякуючы чаму ў ёй лягчэй перамяшчаюцца іёны.
 2 Растворыце ў вадзе 1 сталовую лыжку (20 грамаў) паваранай солі. Насыпце ў шклянку соль і змяшайце ваду, каб яна растварылася. У выніку ў вас атрымаецца солевы раствор.
2 Растворыце ў вадзе 1 сталовую лыжку (20 грамаў) паваранай солі. Насыпце ў шклянку соль і змяшайце ваду, каб яна растварылася. У выніку ў вас атрымаецца солевы раствор. - Хларыд натрыю (гэта значыць павараная соль) з'яўляецца электралітам, які павялічвае электраправоднасць вады. Сама па сабе вада дрэнна праводзіць электрычнасць.
- Пасля таго як вы павялічыце электраправоднасць вады, створаны батарэйкай ток будзе лягчэй праходзіць праз раствор і больш эфектыўна расшчапляць малекулы на вадарод і кісларод.
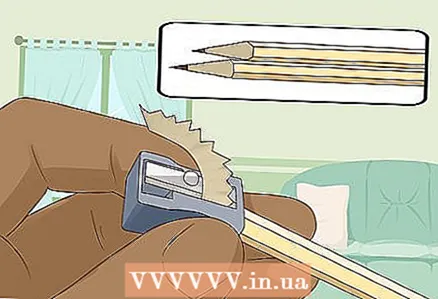 3 Завастрыць два цвёрда-мяккіх алоўка з абодвух канцоў, каб агаліўся графітавых стрыжань. Не забудзьцеся зняць з алоўкаў гумка. На абодвух канцах павінен выступіць графітавых стрыжань.
3 Завастрыць два цвёрда-мяккіх алоўка з абодвух канцоў, каб агаліўся графітавых стрыжань. Не забудзьцеся зняць з алоўкаў гумка. На абодвух канцах павінен выступіць графітавых стрыжань. - Графітавыя стрыжні паслужаць ізаляванымі электродамі, да якіх вы падключыце батарэйку.
- Графіт добра падыходзіць для дадзенага эксперыменту, паколькі ён не раствараецца і ня корродирует ў вадзе.
 4 Выражыце досыць вялікі ліст кардона, каб яго можна было пакласці па-над шклянкі. Выкарыстоўвайце даволі тоўсты кардон, які не правісне пасля таго, як вы праробіце там дзьве адтуліны. Выражыце квадратны кавалак з скрынкі для абутку ці чаго-небудзь падобнага.
4 Выражыце досыць вялікі ліст кардона, каб яго можна было пакласці па-над шклянкі. Выкарыстоўвайце даволі тоўсты кардон, які не правісне пасля таго, як вы праробіце там дзьве адтуліны. Выражыце квадратны кавалак з скрынкі для абутку ці чаго-небудзь падобнага. - Кардон патрэбен для таго, каб утрымліваць алоўкі ў вадзе, так каб яны не тычыліся сценак і дна шклянкі.
- Кардон не праводзіць ток, таму яго можна без боязі пакласці на шклянку.
 5 Прарабіце з дапамогай алоўкаў два адтуліны ў кардоне. Праткніце кардон алоўкамі - у гэтым выпадку яны апынуцца шчыльна заціснутымі і не будуць вылузвацца. Прасачыце, каб графіт не дакранаўся сценак або дна шклянкі, інакш гэта перашкодзіць правесці эксперымент.
5 Прарабіце з дапамогай алоўкаў два адтуліны ў кардоне. Праткніце кардон алоўкамі - у гэтым выпадку яны апынуцца шчыльна заціснутымі і не будуць вылузвацца. Прасачыце, каб графіт не дакранаўся сценак або дна шклянкі, інакш гэта перашкодзіць правесці эксперымент.
Частка 2 з 2: Правядзіце эксперымент
 1 Далучыце да кожнай клемы батарэйкі па адным провадзе з заціскамі «кракадзіл». Крыніцай электрычнага току паслужыць батарэйка, і праз драты з заціскамі і графітавыя стрыжні ток дасягне вады.Падключыце адзін провад з заціскам да станоўчага, а другі - да адмоўнага полюсу батарэйкі.
1 Далучыце да кожнай клемы батарэйкі па адным провадзе з заціскамі «кракадзіл». Крыніцай электрычнага току паслужыць батарэйка, і праз драты з заціскамі і графітавыя стрыжні ток дасягне вады.Падключыце адзін провад з заціскам да станоўчага, а другі - да адмоўнага полюсу батарэйкі. - Выкарыстоўвайце 6-вольтавую батарэйку. Калі ў вас няма такой батарэйкі, замест яе можна ўзяць 9-вольтавую батарэйку.
- Прыдатную батарэйку можна набыць у краме электрычных тавараў або супермаркеце.
 2 Далучыце другія канцы правадоў да алоўкам. Як вынікае замацуеце металічныя заціскі правадоў на графітавых стрыжнях. Магчыма, прыйдзецца счысціць з алоўкаў яшчэ трохі дрэва, каб заціскі не саслізгвалі з графітавых стрыжняў.
2 Далучыце другія канцы правадоў да алоўкам. Як вынікае замацуеце металічныя заціскі правадоў на графітавых стрыжнях. Магчыма, прыйдзецца счысціць з алоўкаў яшчэ трохі дрэва, каб заціскі не саслізгвалі з графітавых стрыжняў. - Такім чынам вы замкнецца ланцуг, і праз ваду пацячэ ток ад батарэйкі.
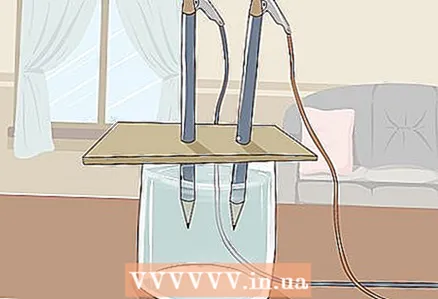 3 Пакладзеце кардон на шклянку так, каб вольныя канцы алоўкаў пагрузіліся ў ваду. Ліст кардона павінен быць дастаткова вялікім, каб устойліва ляжаць на шклянцы. Дзейнічайце акуратна, каб не парушыць правільнае размяшчэнне алоўкаў.
3 Пакладзеце кардон на шклянку так, каб вольныя канцы алоўкаў пагрузіліся ў ваду. Ліст кардона павінен быць дастаткова вялікім, каб устойліва ляжаць на шклянцы. Дзейнічайце акуратна, каб не парушыць правільнае размяшчэнне алоўкаў. - Каб эксперымент атрымаўся, графіт не павінен дакранацца сценак і дна шклянкі. Яшчэ раз праверце гэта і пры неабходнасці папраўце алоўкі.
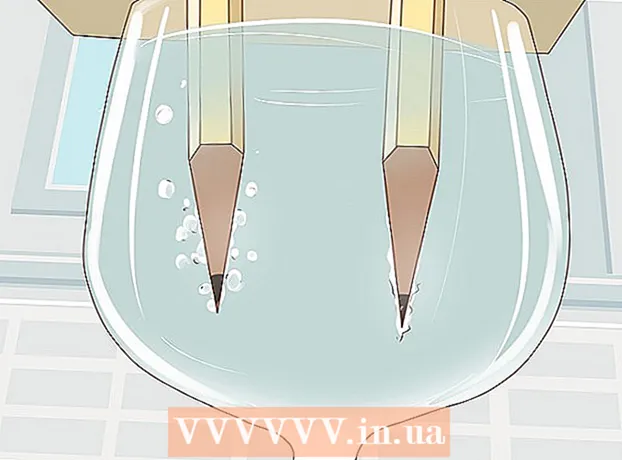
 4 Паназірайце, як вада расшчапляецца на вадарод і кісларод. Ад апушчаных у ваду графітавых стрыжняў пачнуць падымацца бурбалкі газу. Гэта вадарод і кісларод. Вадарод будзе вылучацца на адмоўным, а кісларод - на станоўчым полюсе.
4 Паназірайце, як вада расшчапляецца на вадарод і кісларод. Ад апушчаных у ваду графітавых стрыжняў пачнуць падымацца бурбалкі газу. Гэта вадарод і кісларод. Вадарод будзе вылучацца на адмоўным, а кісларод - на станоўчым полюсе. - Як толькі вы падключыце драты да батарэйцы і графітавым стрыжням, праз ваду пацячэ электрычны ток.
- Больш бурбалак газу будзе ўтварацца на тым карандаше, які падлучаны да адмоўнага полюсу, паколькі кожная малекула вады складаецца з двух атамаў вадароду і аднаго атама кіслароду.
парады
- Калі ў вас няма алоўкаў з графітавымі стрыжнямі, замест іх можна выкарыстоўваць дзве невялікія правалокі. Проста абгарніце адным канцом кожнай правалокі адпаведны полюс батарэйкі, а другі апусціце ў ваду. Атрымаецца той жа вынік, што і з алоўкамі.
- Паспрабуйце выкарыстоўваць іншую батарэйку. Ад вальтажу батарэйкі залежыць велічыня які праходзіць току, якая, у сваю чаргу, уплывае на хуткасць расшчаплення малекул вады.
папярэджання
- Калі вы дадасце ў ваду электраліт, напрыклад соль, то ўлічыце, што ў ходзе эксперыменту будзе ўтварацца невялікая колькасць такога пабочнага прадукту, як хлор. У такіх малых колькасцях яго не будзе шкоды, аднак вы можаце адчуць лёгкі пах хлору.
- Праводзіце дадзены эксперымент пад наглядам дарослых. Ён звязаны з электрычнасцю і газамі, таму можа прадстаўляць небяспеку, хоць гэта малаверагодна.
Што вам спатрэбіцца
- Два цвёрда-мяккіх алоўка
- Адна 6- або 9-вальтовая батарэйка
- Шклянку аб'ёмам 350 мілілітраў
- 2 драты з з заціскамі «кракадзіл»
- Фарматаўкі для алоўкаў
- павараная соль